Para empezar debemos de tener en cuenta que una Teoría es una explicación probable de algún fenómeno observable, la cual se fundamenta con todos aquellos datos obtenidos a través del método científico de dicho fenómeno.
Y bien, lo que busca explicar la Teoría Cinético-Molecular es el comportamiento de la materia, es decir el hecho de que esta se encuentre en un estado SÓLIDO, LÍQUIDO o GASEOSO; así como el cambio de un estado a otro, para lo cual se auxilia de ciertos postulados, los cuales son los siguientes:
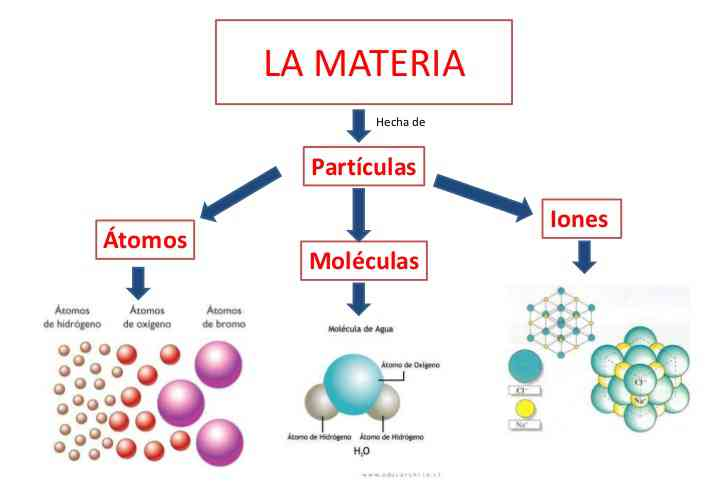
1) Toda la materia esta formada por partículas muy pequeñas, las cuales pueden ser átomos, moléculas y iones.
Por ejemplo, en la siguiente imagen podemos observar que tanto el balón, el agua y el gas están compuestos por pequeñas partículas, las cuales no pueden ser observadas a simple vista, pero ahí se encuentran constituyendo a dichos objetos.
2) Dichas partículas ejercen entre si fuerzas de atracción (fuerzas de cohesión o intermoleculares) lo que ocasiona que estas estén en constante movimiento.
Esto dependerá de cada estado de agregación.
- Estado Sólido: Las moléculas están muy juntas, por lo que presentan un movimiento vibratorio alrededor de posiciones fijas razón por la cual presentan una masa y volumen fijo. Las fuerzas de cohesión son muy grandes.
- Estado Líquido: Las moléculas están más separadas , por lo que presentan un movimiento libre que les permite cambiar de lugar razón por la cual los líquidos pueden fluir y adoptar la forma del recipiente que las contiene. Las fuerzas de cohesión, aunque son menos intensas que en el estado sólido, impiden que las moléculas puedan independizarse.
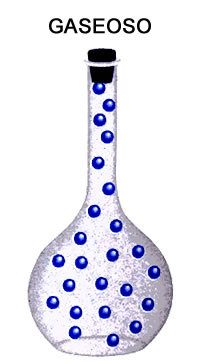
- Estado Gaseoso: Las moléculas se encuentran totalmente separadas unas de otras, por lo que presentan un movimiento aleatorio razón por la cual ocupan todo el espacio disponible y no tienen volumen ni forma fija.Las fuerzas de cohesión son muy débiles o casi nulas.
En la siguiente imagen podemos apreciar más claramente como las moléculas del sólido están muy juntas y ya poseen un volumen propio definido, mientras que las del líquido están más separadas y adoptan la forma del recipiente que las contiene, siendo todo lo contrario en el gaseoso en el cual vemos que sus moléculas están muy separadas y no adoptan la forma del recipiente, pues ocupan un mayor espacio.
3) A mayor temperatura, el movimiento de las partículas es mayor, y por lo tanto también la Energía Cinética. Dando paso a los cambios de estado.
Calor = Energía Cinética = Movimiento
Aquí podemos observar que a medida que se aplica calor, la energía cinética aumenta al igual que el espacio entre las moléculas dando paso a los cambios de estado de sólido a líquido y de líquido a gaseoso. Y por el contrario si se reduce la cantidad de calor, vemos como el espacio entre cada molécula disminuirá dando paso a los a los cambios de estado contrarios a los ya antes mencionados.
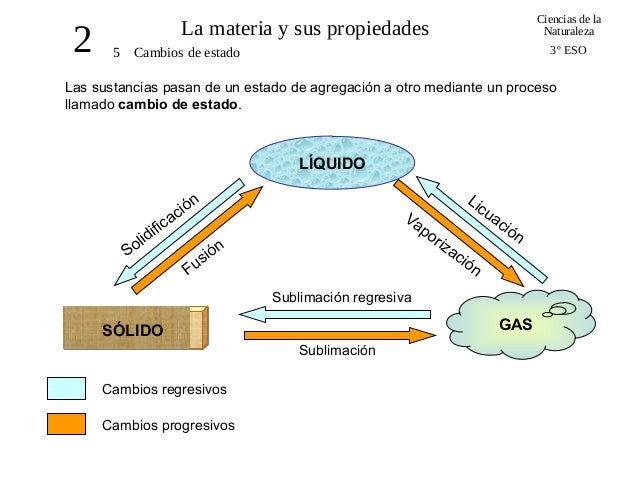 |
Aquí podemos observar que a medida que varia el calor, se generan
los llamados Cambios de Estado. Dicho cambio puede
ser PROGRESIVO si aumenta el calor y REGRESIVO si disminuye.
|
En el siguiente vídeo podemos observar los Cambios Progresivos de la Materia.
4) Los choques entre las partículas, así como con las paredes del recipiente son elásticos, es decir, no hay perdida de la Energía Cinética Total, sólo transmisión.
| CHOQUES ELÁSTICOS ENTRE PARTÍCULAS |
Aquí podemos observar la colisión entre dos partículas, las cuales tienen una masa y una velocidad fijas, de las cuales después de dicho impacto ambas partículas mantienen intacta su masa, mientras que su velocidad cambia, es decir, la velocidad que tenía una partícula se la pasa a la otra y viceversa.
Ec inicial = Ec final
Bibliografías:
- https://teoriacineticadelamateria.blogspot.com/2012/10/postulados-de-la-teoria-cinetica.html
- https://www.quimicaweb.net/actividades/Teoria_cinetica/Teoria_cinetica.htm
- https://www.youtube.com/watch?v=KccTR-QsUkU





No hay comentarios:
Publicar un comentario