Presion
Definimos a la presion como la fuerza dividida por el area sobre la que se aplica dicha fuerza. Cuanto mayor es la fuerza que actua sobre un area dada, mayor es la presion.
 |
| Figura 2. Formula general de la presion |
El origen de la fuerza de ejercida por un gas es el choque incesante de las moleculas contra las paredes del recipiente, estas son tan numerosas que ejercen una fuerza estacionaria eficaz (variable), que se detecta como presion estacionaria. La unidades de esta presion en el SI es el Pa (Pascal) definido como 1 newton por metro cuadrado.
Pa= N/m²
Si introducimos dos gases en dos recipientes separados por una pared movil, el gas que tiene una presion mas elevada tendera a comprimir (reducir el volumen) de aquel gas con presion mas baja, en todo este proceso, el primer gas, de acuerdo a la relacion entre el area y la presion, la cual es inversamente proporcional, al desplazar la pared movil su presion disminuira mientras que la del segundo, aumentara. En algun punto, se llegara a un equilibrio entre las dos presiones de los gases y la pared no se movera mas, como se ve en la siguiente imagen.
 |
| Figura 3. Sistema de presion de gases |
En el caso de los fluidos, la presion puede estar influida por la profundidad y la densidad de los mismos. Consideremos un punto que esta a una profundidad
h de la superficie, la presion debida a esta profundidad es provocada por
el peso de la columna de liquido encima de él.
De esta manera, la fuerza debida al peso del liqudio que actua sobre el area
A es
F=mg=DAhg, donde
D es la densidad del liquido,
Ah el volumen de la columna de liquido y
g la aceleracion de la gravedad. Por lo tanto esta relacion puede ser expresa de la siguiente manera:
P= F/A = DAhg/ A es decir, P=Dgh
De lo anterior podemos decir, que la presion es directamente proporcional a todos los terminos que la componen.
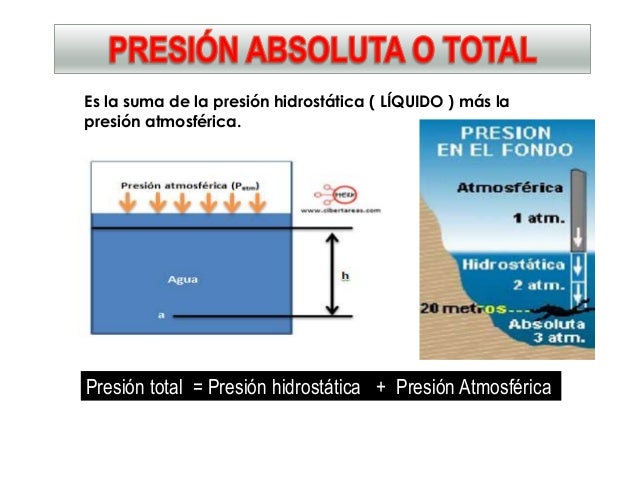
Ahora, para obtener la presion total ejercida sobre dicho punto debe sumarse la presion de la atmosfera, que si se toma en cuenta representaria el doble de la profundidad.
Figura 3: Expresion de la relacion existente entre la presion hidrostatica y la presion atmosferica
Tomando en cuenta esta relacion, deducimos, que si la profundidad aumenta al doble, tambien lo hara la presion, si es al tripe aumentara al triple y asi sucesivamente; si es el caso de la densidad sucedera el mismo fenomeno, el grado en el que aumente la densidad sera proporcional al que aumentara la presion.
La densidad, como propiedad caracteristica de la materia, en el caso de los liquidos no posee significativas variaciones al menos que la temperatura del mismo aumente, por lo que esta propiedad cuantitativa no cambia en la mayoria de las profundidades.
Temperatura
De acuerdo al modelo cinetico de particulas, toda la materia, en sus tres estado de agregacion basicos esta compuesta de atomos y moleculas, los cuales poseen un determinado movimiento que podemos definir como energia cinetica, esta propiedad es de suma importancia dado que el promedio de esta energia determinara cuan caliente estara un determinado objeto.
Por ejemplo, si poner a calentar agua, el movimiento de sus particulas aumentara y por lo tanto se calentara, el mismo caso supone la friccion de un objeto contra otro como es el caso de los neumaticos de un automovil con el pavimento.
 |
Figura 4: Representacion de movimiento molecular
|
Cuando un determinado objeto se calienta, sus molecular se mueven con mayor rapidez, por lo tanto hay un aumento en el valor de la energia cinetica.
A la propiedad que deriva de esta relacion se le denomina temperatura y en el modelo cinetico de particulas es definida como el promedio de la energia cinetica de las particulas de un cuerpo.
A su vez, la mayoria de los objetos al aumentar su temperatura se expanden, como es el caso de las vias del metro de la Ciudad de Mexico en una epoca calurosa, que por accion tanto de la friccion causada por el paso de los trenes como la exposicion a los rayos del sol, las vias sufren una modificacion en su volumen, el cual aumenta.
 |
| Figura 5: Representacion grafica de la dilatacion en una via |
Esta dilatacion es util para la medicion de la temperatura de los cuerpos, y es un principio fisico utilizado por los termometros, como es el caso del de mercurio.
El mercurio es uno de los metales con alto indice de dilatacion, de modo que ser expuesto a una sustancia determinada la cual posea una temperatura elevada, la dilatacion del mercurio sea facilmente visible.
 |
| Figura 6: Termometro de mercurio |
En el cuerpo, el aumento de la temperatura corporal puede representar un serio problema que puede llevar a un individuo a la muerte.
Uno de estos casos es el sincope por calor, que es una reaccion sistemica secundaria a la perdida de sales y agua derivadas principalmente de un aumento excesivo en la temperatura corporal, como consecuencia, hay presencia de cefaleas (dolor de cabeza), vertigo, hipotension y taquicardia.
 |
| Figura 7: Representacion grafica del padecimiento |
Uno de los principales mecanismos de regulacion homeostatica (equilibrio corporal) es la vasodilatacion periferica, en este hay un aumento en el diametro del vaso sanguineo para que circule con mayor facilidad la sangre y por lo tanto hay una mayor redistribucion de la sangre, lo que permite una mayor perdida de calor.
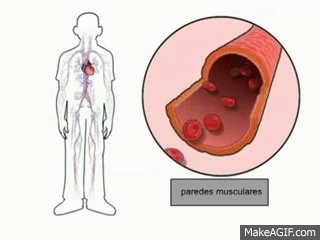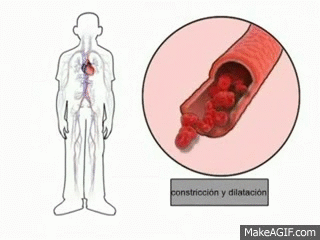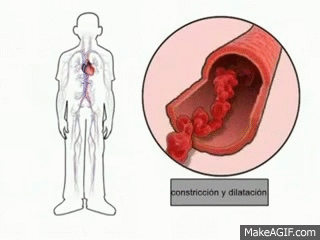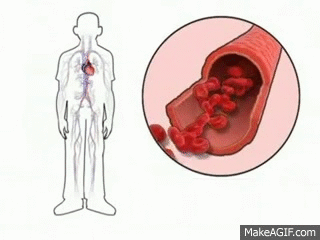 |
| Figura 7: Vasodilatacion |
Esta vasodilatacion permite que se de una mayor liberacion de sudor y por lo tanto la temperatura corporal disminuya a niveles normales.
Fuentes de consulta.
- Atkins, P. (1999). Fisicoquimica. Barcelona: Ediciones Omega
- Giancoli, D.(2008). Fisica para ciencias e ingenieria. Mexico: Peason Educacion
- Gomez, A. Transtornos de la temperatura corporal. Recuperado el dia 30 de diciembre de 2018 en: http://www.elsevier.es/es-revista-offarm-4-articulo-trastornos-temperatura-corporal-13108301
- Sosa, S. Vasodilatacion: Fisiologia, sustancias vasodilatadoras. Recuperado el dia 30 de diciembre de 2018 en: https://www.lifeder.com/vasodilatacion/





















:max_bytes(150000):strip_icc()/diffusion-in-water-530463502-5766aaec3df78ca6e4a98185.jpg)